
一、肿瘤外科的简史
外科手术是肿瘤治疗的最常用方法。1890年美国外科医生Ephrain McDowell为一位患者切除了9.9kg(22磅)重的卵巢肿瘤,术后病人生存30年。这是世界首例腹部选择性手术,从而开创了肿瘤择期手术方式。
1882年Halsted 首创的乳腺癌根治术。他根据既往乳腺外科手术的缺点以及乳腺癌的淋巴转移途径,提出了乳腺癌的外科治疗,应整块切除全乳腺,包括一定范围的乳腺皮肤,乳腺周围脂肪组织、胸大小肌及腋窝脂肪淋巴组织。这是肿瘤外科史上的一个里程碑,建立了肿瘤外科治疗的基本原则——整块切除原则。同时也使外科手术至今仍在有效的肿瘤治疗中居主导地位。
之后,肿瘤外科蓬勃发展,1860年Albert Theodore Billroth 开展了胃癌手术;1908年W. Ernest Miles 创立了直肠癌腹会阴联合根治术;1910年Cushing首次进行脑瘤手术,1913年Franz Toret首例胸段食管癌切除成功,1933年Graham成功切除全肺,1935年A. O. Whipple完成了复杂的胰十二指肠切除。至此,几乎人体所有重要脏器的恶性肿瘤都可经手术治疗了。1958年Bernard Fisher创立NSABP组织,倡导前瞻性随机对照研究,使肿瘤的外科研究进入了一个新的阶段。
20世纪末,随着显微外科技术、微创外科技术、多学科合作观念。麻醉水平提高及抗菌药物的广泛应用,使器官移植、重建和康复手术等被引入肿瘤外科治疗领域。
二、肿瘤外科的目的及手术分类
根据手术的目的不同,肿瘤手术可以分为以下几类:
1.根治性手术:一般来讲,根治性手术的范围包括原发癌所在器官的部分或全部,连同周围正常组织和区域淋巴结。
2.姑息性手术:以解除或减轻症状为目的。例如:胃癌伴幽门梗阻者行胃空肠吻合术;胰头癌伴有黄疸,而肿瘤无法切除者,行胆总管空肠吻合,以解除胆道梗阻。姑息性手术后可减轻症状,提高生活质量,为进一步的综合治疗提供条件,延长生命。
3.预防性手术:某些疾病或先天性病变在发展到一定程度时,可发生恶变,临床上称此为癌前病变。对于这些有癌变可能的疾病进行预防性手术切除,可以有效预防肿瘤的发生。如切除足底、外阴等易受摩擦部位的黑痣,可以防止其转变为恶性黑色素瘤;口腔粘膜白斑病的预防性切除等。
4.诊断性手术:明确诊断,获得准确的病理分期,是肿瘤治疗必不可少的。如淋巴结活检是恶性淋巴瘤治疗的前提;卵巢癌行剖腹探查,了解其分期。
5.重建或康复手术:肿瘤外科医生在手术治疗肿瘤时,还要注意病人生存质量,设法为病人进行重建或康复治疗,使病人外形及功能有改善。因此,外科手术亦常应用于肿瘤病人手术后的重建与康复,这是新医学模式的要求。例如乳腺癌根治术后的乳房再造手术;喉癌根治术后的喉重建;全舌切除术后舌再造;上颌窦癌切除术后的面部整形;腹壁和胸壁巨大肿瘤切除术后的修补等等。有些由于以往手术或放疗后所致的功能丧失,特别是肢体,可以通过骨或肌肉的移位而使其功能改善。
三、肿瘤外科治疗原则
(一)良性肿瘤的外科治疗原则
良性肿瘤以局部膨胀性生长为主,其边界清楚,多数有完整的包膜,不会发生淋巴道和血道侵袭和转移,其治疗以手术为主,一般手术切除即可治愈。手术原则是完整切除肿瘤,应包括肿瘤包膜及少量正常组织,禁忌作肿瘤挖出术。例如乳腺纤维腺瘤需作乳腺区段切除;甲状腺瘤要求作肿瘤所在的腺叶及峡部切除;卵巢囊肿则作单侧卵巢切除,并避免术中囊肿破裂。诚然:有些部位特殊,不容大范围切除,如神经纤维瘤、神经鞘瘤、脑膜瘤、垂体瘤等,有时只能剥离肿瘤或大部分切除。必须强调,切除的肿瘤必须送病理检查,进一步明确病理性质,以避免将恶性肿瘤误诊为良性肿瘤而不再作进一步治疗。一旦发现所切出的“良性肿瘤”实则是恶性肿瘤,则应按恶性肿瘤重新处理。对一些良性肿瘤有可能发生恶性变者,以及交界性肿瘤,切除范围亦应较广。
(二)恶性肿瘤的外科治疗原则:
1.明确诊断:术前对病变作出正确的诊断和分期,以选择恰当的治疗方法。对于可能要进行重要器官切除或可能致残的手术,在术前一定要取得病理学依据;切忌凭主观臆断。另外,术前要充分估计手术切除的可能性,是根治性还是姑息性,手术与其他治疗方法的配合等。
2.选择最佳的综合治疗方案,控制局部病灶,防止远处转移。肿瘤的处理十分强调首次治疗,首次治疗是否正确,将直接影响预后。一般的原则是:早期肿瘤,争取手术根治;局部晚期癌肿,可考虑新辅助治疗,待肿瘤缩小后再手术;术后病理证实有癌残留或多个淋巴结转移者,作术后辅助治疗。选择合理的术式应遵守下列几项原则:必须依据各种肿瘤的生物学特性选择术式。上皮癌常有淋巴道转移,应将其区域淋巴结清除干净(原位癌和早期浸润癌可除外);肉瘤易局部复发而很少发生淋巴道转:广泛切除而不作常规区域淋巴结清除;食管癌、胃癌、大肠癌等有多中心起源的,切除的范围应尽量扩大;肌肉的肉瘤易沿肌间隙扩散,应将该肌肉连同筋膜从止点全部切除,保证足够的切除范围。手术切除范围应遵照“两个最大”的原则,即最大限度地切除肿瘤和最大限度地保护正常组织,在达到根治的目的下,应尽量使外形和功能接近正常。当两个最大限度有矛盾时应服从前者。术式往往需在探查后作最后的抉择,因而要求术者不但要非常熟悉患者在术前的各项资料,在术中详细了解肿瘤的浸润、转移情况,并根据转移情况(有时需在术中冰冻病理检查)来确定术式。
3.依据患者年龄、全身状况选择术式。一般来说,年龄过大、身体状况欠佳者不宜手术,恶液质酌患者为手术禁忌。值得注意的是,有些患者看来全身状况很差(如严重失水、胃肠道癌合并大出血等),但通过积极的治疗得到改善仍可手术的慢性病(如结核、高血压、糖尿病等)会影响手术的实施,应做好术前治疗并依情况选择术式。
4.避免医源性肿瘤播散
任何由于检查或治疗而引起的肿瘤播散称为医源性播散,而预防医源性播散的方法称为无瘤原则。在肿瘤外科中无瘤原则与无菌原则具有同等重要的地位。
(1)防止肿瘤细胞的播散
在各种检查和手术操作中应注意动作轻巧,做到稳、准、轻、快,防止肿瘤细胞播散。以下为经常注意的事项:①术前检查应轻柔,避免不必要的检查;②术前皮肤准备应轻巧,减少局部摩擦;③尽量避免局麻,防止局部压力升高所致的癌细胞播散;④能够进行切除活检者,应避免切取活检;⑤探查由远至近,动作轻柔。例如对上腹部肿瘤应先探查盆底,然后逐渐向上腹部延伸,最后后探查肿瘤;下腹部的肿瘤探查顺序则相反,这样可尽量避免将肿瘤细胞带至远处;⑥手术暴露要清楚,避免挤压肿瘤;⑦尽量使用锐性分离,术中多采用电刀切割,不仅可以减少出血,同时由于小血管及淋巴管被封闭,且高频电刀有杀灭肿瘤的功能,因而可以减少血行播散和局部种植;⑧与其他外科不同,肿瘤外科手术应先结扎静脉,后结扎动脉,减少肿瘤血行播散;⑨先处理手术切除的周围部分,再处理肿瘤邻近部位,与原发灶一起作整块切除。
(2)防止肿瘤细胞的局部种植
为了防止肿瘤细胞的局部种植,手术时应注意:①手术切口应用纱布垫或塑料布保护;②肿瘤如果有破溃或侵出浆膜层时,应用纱布垫或塑料布包扎,与正常组织隔离;③手套或器械尽量避免直接接触肿瘤,一旦有肿瘤污染可能,应及时更换;④结直肠癌手术时,先用结扎带结扎肿瘤的上下端肠管,避免肿瘤种植;⑤肿瘤切除后,应用含有化疗药物的蒸馏水彻底冲洗。
目前,放射治疗已成为恶性肿瘤的主要治疗手段之一,据国内外文献的报道,所有恶性肿瘤患者的70%左右,在病程的不同时期都需要作放射治疗。有些肿瘤单纯放射治疗能够治愈, 如I期鼻咽癌单纯放射治疗的5年生存率达到95%左右,局部晚期鼻咽癌选择以放射治疗为主的同步放化疗5年生存率也提高到60-70%左右。早期声门型喉癌、口腔癌、宫颈癌可首选放射治疗,同时放射治疗与化疗/手术综合治疗在头颈部肿瘤器官功能保全治疗中起到重要作用。
一、放射物理概述
(一)电离辐射有两大类:电磁辐射和粒子辐射。
1. 粒子辐射包括电子、质子、中子、负介子和氦、碳、氮、氧、氖等重粒子,除去中子不带电外,所有其他粒子都带电。它们的物理特点之一就是在组织中具有一定的射程,即达到一定深度后,辐射能量急剧降为零,形成Bragg峰。这一特点在临床治疗中有重要意义,位于射程以外的组织可以免受辐射的作用,认识这点有利于保护肿瘤周围的正常组织。
2. 电磁辐射由X线和线组成,前者由X线治疗机和各类加速器产生,后者在放射性同位素蜕变过程中产生,目前临床上常用的有钴-60,铯-137,铱-192。
(二)放射治疗中常用的放射线剂量单位为吸收剂量,即单位质量所吸收的电离辐射能量,按照SI单位制吸收剂量单位为戈瑞(Gray),以符号Gy表示,1Gy=1 J/kg,1Cy=100cGy。R(伦琴)则为照射量的单位,1R=2.58x10-4C/kg。
(三)临床实践中应用的X线按其能量高低可分为:①接触X线或浅层X线:10-125KV,适用于治疗皮肤表面或皮下1厘米以内病变。②深部X线:125~400KV,适用于治疗体内浅部病变。③高压X线:400KV~1MV。④高能X线:2~50MV,主要由电子直线加速器产生,为目前放射治疗中最为广泛应用的治疗设备,它可治疗体内各个部位的肿瘤。X线能量增加穿透能力亦增加,高能X线骨吸收与软组织吸收相近,最大剂量点在皮下,有保护皮肤作用。
照射方法:临床上常用的照射方法有两大类:近距离放射和远距离放射。
1.近距离放射时把密封的放射源置于需要治疗的组织内(组织间照射)或人体天然腔内(腔内照射)。近距离照射时剂量主要受距离平方反比定律的影响,随着与施源器的距离增加剂量迅速降低。以往,作组织间插植或腔内照射时使用的放射源为镭和氡,由于其半衰期太长,给放射防护带来很大困难,现已废弃不用而为人工同位素,如137Cs、192Ir和60Co替代。
近距离治疗的优点是可在肿瘤组织内给以高剂量照射,而周围正常组织的受量小,低剂量率持续照射还具有某些生物学上的优点;缺点是靶区内剂量分布不均匀,治疗的容积不宜太大,其应用也受到解剖部位的限制。因此,近距离治疗主要用于对肿瘤局部的加量照射,在多数情况下要与外照射配合使用。
2.远距离照射时,照射装置远离病人,放射线必须经过体表皮肤及体内正常组织,然后才能达到肿瘤组织,也称为外照射。这是目前放射治疗中应用最多的照射方式,其体内剂量分布取决于射线能量、源皮距、体内吸收物的密度和原子序数。外照射的临床剂量学的原则是:①靶区的剂量要求准确;②靶区内剂量分布要均匀,最高剂量与最低剂量的差异不能超过10%;③应尽量提高治疗区域内剂量,尽量使周围正常组织的剂量减少至最低程度;④尽可能不照射或少照射肿瘤周围的重要器官,如脊髓、眼、肾等,其照射剂量不能超过其耐受量。
国际射线委员会(1CRU)报告29对外照射剂量分布作了如下规定:
肿瘤区:通过临床体查和各种影像诊断手段确定的肿瘤大体范围。
靶区:肿瘤区加上其周围有显微扩散的范围。
计划区:包括靶区本身生理性运动范围及日常治疗中摆位引起的变动范围。’
治疗区:治疗计划中80%等剂量线所包括的范围,其形状和大小应尽可能与计划区相符。
照射区:治疗计划中50%等剂量线包括的范围。
(五)放射治疗的实施过程
1. 治疗方针的确定:在肿瘤确诊后,根据病人肿瘤的类型、部位、临床分期以及病人的身体状况等因素确定治疗方针,即是否要做放射治疗?放疗的目的是根治性的、辅助性的还是姑息性的。
2. 确定靶区:也即确定照射的部位和范围。体表肿瘤往往通过体格检查就能确定靶区,但体内的肿瘤都需要凭借多种影像诊断手段,如X线检查、B超、CT或MRI等检查来确定体内务部位肿瘤的位置、体积及其周围器官的侵犯情况,局部和区域淋巴结转移情况等来确定靶区。肿瘤的病理类型、分化程度等对靶区确定也有重要意义,治疗方针不同对靶区的确定也有影响。
3. 制定治疗计划:根据靶区的部位、大小、与周围重要器官的解剖关系等,利用计算机治疗计划系统制定治疗计划,确定照射野的大小、数目及其配置,放射源的选择,照射方式(垂直照射、成角照射,源皮距、等中心照射等),是否需用修饰射线的装置,如楔形滤过板、个体化的挡块、甚或多叶光栅的使用等。
4. 治疗计划的验证和定位:治疗计划经临床医生审核确定后必须在模拟机上复核、定位。
5. 治疗计划的执行:治疗计划经模拟机核对后就可以正式开始治疗。在有条件的单位,第一次治疗时应该在治疗机上摄取射野证实片,对治疗计划作进一步核实。
(六)放射治疗新技术
三维适形放射治疗/调强放射治疗
随着计算机技术的进步和加速器设备的升级,放射剂量分布在空间三维方向上与肿瘤形状一致的三维适形放射治疗(3-Demensional Conformal Radiotherapy,3-DCRT)技术和不仅剂量分布与肿瘤形状一致,而且剂量强度分布也可以调节的调强适形放射治疗(Intensity Modulated Radiotherapy, IMRT)技术得以实现,在放射物理的保障下,这些技术在临床上的应用越来越普及。
二、放射生物概述
(一)放射线对生物体作用时,细胞关键的靶为DNA,它的作用可分为直接作用和间接作用。放射线可直接作用于DNA,使其结构改变,由此产生生物效应,这种直接作用主要见于高LET射线。间接作用是放射线与生物体内占主要组分的水分子作用,产生H20+和OH等自由基,后者可对DNA造成损伤,低LET射线以间接作用为主。这种作用可以进行修饰以达到增强或减弱放射效应的目的。氧是最有效的放射敏感性化学修饰剂,可与离子基结合生成过氧化物。后者比自由基更稳定,存在时间较自由基长,毒性亦更大,故能提高放射线杀伤作用。
(二)放射线的生物效应与细胞丧失无限增殖能力有关。因此,损伤显现的快慢,至少部分地与组织的增殖活力有关。增殖活跃的组织,如消化道粘膜、骨髓和皮肤表皮等损伤显现得早,而由缓慢增殖细胞组成的组织如中枢神经系统和周围神经系统、肾、真皮、软骨和骨显现损伤慢。这些组织的损伤主要与其中靶细胞的枯竭有关。
(三)放射线杀伤细胞的程度与剂量的大小有关,这种量效关系可用细胞存活曲线来表示。它的特点可用下列参数来描述:D。值是曲线直线部分,使细胞存活下降到.照射前37%所需的剂量,亦称为平均致死剂量;外推值n和准阈剂量D,是反映肩区大小的参数;初始斜率D:是指存活曲线的初始直线部分,亦即在低剂量区存活细胞分数降低到37%时所需的剂量。如同一实验数据用线性二次模型拟合时,存活曲线由两部分组成,起始部分与剂量成正比,系数决定低剂量照射时的损伤程度;后一部分与剂量平方成比例,系数代表效应的超线性部分。/值是指两个杀灭部分相等时的剂量。
(四)分割照射过程中,正常组织和肿瘤的反应
1.放射损伤的修复
细胞受照射后可产生致死性损伤或其损伤可被修复,不引起细胞死亡。放射损伤修复可分为潜在致死损伤修复和亚致死损伤修复。
潜在致死损伤修复是指在某些情况下可导致细胞死亡的损伤,如果照射后条件改变容许修复时,原本要死亡的细胞可得到挽救。总的来说,照射后细胞分裂受到抑制时最有利于潜在致死损伤的修复。潜在致死损伤修复和许多因素有关。高LET射线照射时没有潜在致死损伤修复。它与和细胞周期时相关系密切,只见于S期。
亚致死损伤的修复:细胞生存曲线中肩区的存在表明细胞能够修复某些损伤,即亚致死损伤。亚致死损伤修复与许多因素有关。高LET射线照射后没有亚致死损伤修复。乏氧细胞亚致死损伤修复减少。亚致死损伤修复通常进行得很快,照射后1小时内出现,4-8小时内即可完成。
2.再氧化:目前已知,电离辐射生物效应最重要的修饰剂是氧分子。要获得相同的细胞杀伤,乏氧条件下所需的剂量比有氧条件下的剂量要高。氧效应可用氧增强比OER表示。用X线或线照射时,哺乳动物细胞的OER在2.5-3.5,这表示要获得相同的杀伤,乏氧条件下的照射剂量是有氧时剂量的3倍。
现已证明实验动物肿瘤含有乏氧细胞。Thomlinson和Gray首先提出人肿瘤中有乏氧区域存在。乏氧并不是一个恒定的因素,这与在分割照射过程中肿瘤细胞的再氧化有关。照射后,由于肿瘤细胞总数减少,血供不变时血管密度相应增加,缩短了血管与原来乏氧细胞之间的距离。照射后肿瘤细胞总数减少降低了氧的消耗,因与血管距离加大而产生的氧分压降低的梯度变浅。由于这些因素的存在,肿瘤组织在分割照射过程中出现再氧化。
动物实验提示再氧化出现的速率有很大的变动,一般很快发生,绝大多数在6~12小时内完成。但人肿瘤再氧化出现的快慢尚无确切的资料。
3.细胞增殖周期的再分布
细胞处于不同的增殖周期时相放射敏感性是不同的。M.Terasima等研究发现M期最敏感,C2期也敏感,Gl后期及S期抗拒。单次剂量照射后,由于敏感时相的细胞优先被杀灭的结果,原来不同步的细胞群会同步处于比较抗拒的增殖时相。当这些较为抗拒的细胞重新进行增殖时会进人较为敏感的时相。这种细胞增殖周期的再分布产生了“自身增敏作用”。不产生增殖的细胞群内则无此作用。
4.细胞再增殖:在分割照射过程中,两次分割照射间歇期可有细胞增殖出现。
目前已有证据表明人肿瘤在放疗期间也有加速再增殖。这主要从头颈部肿瘤治疗结果的分析中得到。从TCD50的分析中发现头颈部鳞癌再增殖的时间在治疗后4周左右开始,以后就出现加速再增殖。
治疗总时间的长短对人肿瘤局部控制率的影响比一般认为的要大。由于在放疗过程中有肿瘤再增殖,因此,不必要的延长治疗时间是有害的。如果由于急性反应在疗程中需要暂时中断时,应尽可能的短。非医疗原因造成的治疗中断(机器故障、假日)可通过一天治疗两次来补偿。有计划的分段治疗是不可取的。生长快速的肿瘤一定要加快治疗,对有高增殖指数的肿瘤,不论其生长速率快慢,也应加快治疗,因为治疗后它们可能因细胞丢失率降低而加速增长。实际上,各种肿瘤的治疗应尽可能地快。
(五)正常组织和肿瘤组织放射反应的动力学
不同的正常组织对放射的反应也不同,按其反应发生的情况可分为早反应组织和晚反应组织两大类。一般认为增殖活跃、更新快的组织属早反应组织,如表皮、骨髓、消化道粘膜等;而增殖缓慢、更新慢的组织,如中枢神经系统和周围神经系统,肾,软骨和骨等属晚反应组织。
早反应组织的放射损伤表现为急性反应。晚反应组织的放射损伤表现为晚期反应,产生的速率与剂量有关。照射剂量越高,放射损伤也越大,损伤出现得更快。
早、晚反应组织在分割照射中反应的不同有重要的临床意义。分割照射时,单次剂量大对晚反应组织的损害大。用两个不同的分割照射方案获得相同的急性反应时,单次剂量大的方案晚期反应严重。采用单次最小有效剂量治疗肿瘤时可提高晚反应组织的耐受量,从而提高治疗增益。为了达到最大的治疗增益,晚反应组织的亚致死损伤修复必需彻底。在每天多次分割照射时,两次照射的间隔时间至少需6小时;脊髓亚致死损伤的修复时间甚至更长。
绝大多数肿瘤均含有一定比例的增殖迅速的细胞。因此,它对分割照射中的反应与早反应正常组织相似。
内科肿瘤学(Medical Oncology)是一门正在迅速发展中的学科。其主要任务是应用药物, 内分泌,生物和基因治疗为肿瘤病人服务。在过去半个世纪,肿瘤内科治疗已经建立了一些重要的生物学和药理学概念,包括肿瘤负荷的大小、细胞的异质性、耐药、给药方法和剂量强度、宿主因素等对疗效的影响;以及综合应用化疗、内分泌治疗、或生物治疗等所取得的成功。这些概念可以作为进一步深入理解主要影响肿瘤细胞增殖的内科治疗机制的基础。而肿瘤研究的各个领域所取得的进展如肿瘤生物学, 新抗肿瘤药物和新机制、化学预防、单克隆抗体、分子生物学研究等都必然会进一步促进内科治疗的进展。当前,在多数常见肿瘤的综合治疗中内科治疗已经是不可或缺的重要手段之一。而临床经验的积累、治疗策略和用药艺术的提高,必然会进一步提高疗效,给病人带来较大的裨益。
一、 内科治疗的历史回顾
无论东方或西方,几千年前即有应用药物治疗“肿瘤”的历史记载。但近代肿瘤内科治疗的开端是本世纪40年代Farber应用抗叶酸制剂和Gilman 等应用烷化剂获得成功,被认为是近代肿瘤化疗的第一个里程碑。这时发展的新药大多是随机筛选通过动物移植性肿瘤寻找的。直到1957年根据一定设想,Arnold合成了环磷酰胺,Duschinsky合成了5-氟尿嘧啶,并在临床上取得相当成功,对有些实体瘤也有一定疗效。肿瘤化疗受到更广泛的重视。这是根据一定理论而合成的有效抗肿瘤药物,因之被认为是肿瘤内科治疗前进中的第二个里程碑。七十年代初进入临床的顺铂和阿霉素由于适应症更广,疗效也有进一步提高,被认为是前进中的第三个里程碑。这时,由于经验的积累,肿瘤内科治疗在睾丸肿瘤、滋养叶细胞肿瘤和儿童白血病已能取得根治性疗效。所以,人们不再把内科治疗只当是姑息性治疗手段,而是追求根治。虽然内科治疗迄今还未能治愈多数晚期肿瘤患者,但化疗根治的概念已被普遍接受,而且是指导临床取得成功的原则之一。
近几年来由于作用机制新颖的几种抗癌药进入临床,最重要的是抑制微管蛋白解聚的紫杉类和拓扑异构酶Ⅰ抑制剂喜树碱衍生物。同时,由于多药耐药基因的发现、生物和基因治疗在临床上取得一定成功,使得肿瘤内科治疗更为丰富多彩,成为学术界最活跃的一个研究领域。而更重要的是,人们对影响疗效的内在因素-肿瘤细胞免疫和抑癌基因等的认识也愈来愈深入;辅助治疗如造血因子的输注和解决化疗引起的严重呕吐的成功;对化疗的剂量强度的掌握,化疗后病人骨髓功能和内在抗病能力的恢复等方面也都积累了一定经验,使得治疗更为合理。进入新世纪以来,根据肿瘤的基因、受体和激酶而发展的靶向治疗使得疗效较大幅度提高而且更为个体化。这无疑是新世纪内科肿瘤学发展的重要方向。
我国现代肿瘤内科治疗的已经始于20世纪50年代。我们首先研制的是放线菌素K,以后合成了几种烷化剂,如N-甲酰溶肉瘤素、消瘤芥、甲氧芳芥、甘磷酰芥等,对常见肿瘤均有一定疗效。60年代以后从我国土壤中陆续分离提取到更生霉素、平阳霉素、博安霉素等。在此同时从植物中提取有效成分也取得成功,包括长春碱类(长春碱、长春新碱、长春酰胺、长春瑞宾等)、喜树碱类(喜树碱、羟基喜树碱)、榄香烯、由苡米仁中提取的康莱特、猪苓多糖、仙灵多糖、黄芪多糖和人参皂甙等。从中药青黛中提取的有些成分对慢性白血病有效,以后又半合成了疗效进一步提高。从植物三尖杉中提取的三尖杉酯碱和高三尖杉碱对急性非细胞细胞白血病有突出疗效,目前在国际上作为三线药物应用。应用维甲酸制剂和三氧化二砷治疗白血病是我国临床肿瘤学家的创举,目前已经得到国际上承认广泛应用。我国在应用中药复方作为辅助治疗具有一定现实应用意义,也经国际同行广泛验证(9,10)。近年来我国在研制具有自主知识产权的新药也有一些成绩,例如肿瘤新生血管抑制剂Endostatin目前已经进入III期临床研究,人参皂甙Rg3也就完成II2期双盲对比研究。
近几年来很多国际创新药物在我国开展符合GCP的多中心临床研究,例如来曲唑和三苯氧胺的多中心双盲对比(025)研究,依西美坦和三苯氧胺对比研究,曲洛昔芬治疗晚期乳腺癌的研究,IRESSA的INTEREST、曲妥珠单抗的HERA研究,等等。
从60年代开始我国制药行业在常用抗肿瘤药物的仿制方面做了大量工作。大多数国际常用的药物我们均能自己生产。我国的基本药品抗肿瘤药物部分为WHO规定的两倍,已经和发达国家相近。
二、内科治疗的水平
如前所述, 目前人们已经不再把内科治疗看成是只能起姑息性作用的一种手段,而是正在从姑息向根治过渡。使用适当,有近20种肿瘤治愈率可得提高。在一些肿瘤的综合治疗中占相当重要的地位。(表2)
目前能够通过内科治疗取得根治性疗效的肿瘤(治愈率在30%以上)有:淋巴瘤、睾丸肿瘤、滋养叶细胞肿瘤、某些儿童肿瘤和急性白血病等;术后应用能在一定程度上提高治愈率的肿瘤有:乳腺癌、大肠癌、卵巢癌和软组织肉瘤;可以明显延长生存期(治愈率在30%以下)的晚期肿瘤有:小细胞肺癌、非小细胞肺癌、大肠癌、胃癌、卵巢癌、头颈部癌等;有一定疗效,但尚未证明能延长生存期的有:肾癌、黑色素瘤、前列腺癌、子宫内膜癌等。
肿瘤内科治疗的水平
1.可根治的肿瘤(治愈率>30%) 3.姑息疗效
滋养细胞肿瘤 肾癌
睾丸生殖细胞肿瘤 黑色素瘤
Hodgkin病 子宫内膜癌
Burkitt淋巴瘤 前列腺癌
大细胞淋巴瘤 慢性白血病
儿童急性淋巴细胞白血病 多发性骨髓瘤
儿童神经母细胞瘤 头颈部癌
Wilms瘤 胃肠道癌
2.少数病人可能根治的肿瘤(治愈率<30%) 4.配合手术/放疗可提高治愈率
急性粒细胞白血病 乳腺癌
成人急性淋巴细胞白血病 大肠癌
骨肉瘤 骨肉瘤
小细胞肺癌 软组织肉瘤
乳腺癌 非小细胞肺癌
部分卵巢癌 视网膜母细胞瘤
肝癌(动脉化疗) 神经母细胞瘤
所以,在常见临床肿瘤的综合治疗中内科治疗一点地位都没有的已经很少了。随着研究的不断进展,新药和新疗法的不断涌现,人们有理由相信内科治疗已经和手术治疗、放射治疗并列,成为防治肿瘤的三个主要手段之一。内科治疗在综合中的地位越来越重要。
三、 内科治疗的原则
(一)综合治疗
内科治疗首先应遵循整个综合治疗的计划,有计划地、合理地在特定的阶段进行。对于早期病例,在手术治疗后辅以药物或免疫治疗,也已有了一些比较重要的成果。肿瘤治疗目前已进入综合治疗的时代。医生的任务是如何掌握和安排各种有效的治疗手段,提高疗效、治愈更多病人。
内科治疗着眼于全身,通过药物治疗最大限度地杀伤肿瘤细胞和增进机体的免疫功能。待到比较局限的时候应适当采用手术或放疗以进一步消灭残存的肿瘤,并积极扶正以争取治愈。近40年来,人们越来越明确综合应用一种以上治疗手段可以提高对常见实体瘤的疗效。最先证明综合治疗重要的例子是儿童肿瘤。通过应用联合化疗、手术切除和局部放疗可以提高肾母细胞瘤、尤文氏瘤和神经母细胞瘤的治愈率。对于成人的恶性肿瘤,综合治疗的发展相对较晚,但综合治疗的概念已经确立。最好的例子是临床局限的乳腺癌在适当的局部治疗后再给予内科治疗的重要性。多年来人们知道手术切除乳腺可以治愈乳腺癌;但同时也十分清楚尽管已将可见的肿瘤切除,很多病人仍死于手术时已经存在的微小转移灶。在适当的局部切除或放射后应用内科治疗,包括细胞毒性化疗、内分泌治疗或化疗加内分泌治疗,可以提高这些病人的治愈率。辅助治疗在大肠癌、卵巢癌和淋巴瘤也已证明能够提高治愈率。
1. 内科治疗在肿瘤综合治疗中可以发挥作用:
(1)术后应用消灭可能存在的微小转移灶,提高外科治疗的治愈率。一般称为辅助化疗(adjuvant chemotherapy);
(2)术前化疗(primary chemotherapy), 也有人称为新辅助化疗(neo-adjuvant chemotherapy), 目的是降低肿瘤负荷和及早控制远处转移灶。目前正在研究的的很多,比较成功的有卵巢癌、骨及软组织肉瘤、肛门癌、膀胱癌、乳腺癌和非小细胞肺癌;
(3) 原来不能手术和本来不宜手术的病人, 在化疗后变为可以手术。 随着非手术治疗的发展,肿瘤外科肿瘤的基本原则已经在一些肿瘤动摇。也就是不能完全切净的也可手术,而将残存的肿瘤留给放疗或化疗。比较重要的是卵巢癌和睾丸肿瘤。
(4)多发或已经广泛播散病人,应以内科治疗为主。 在比较局限时可适当配合区域性放疗。这些病人在化疗期间和化疗后一般应配合适当的生物治疗,提高病人的免疫功能使疗效更为巩固。这方面已经有一些例子, 如非霍奇金淋巴瘤, 晚期胃癌和乳腺癌等;
(5) 生物治疗加化疗 BRM加化疗可以提高远期生存率的资料已经不少。 其中包括干扰素和CHOP治疗淋巴瘤, 香菇多糖加化疗治疗晚期胃癌及应用扶正中药和放射治疗子宫颈癌和乳腺癌等。
(6) 靶向治疗加化疗 靶向治疗配合化疗被认为是近年来一大突破。例如针对肿瘤细胞核内her-2基因过度表达而研制的单克隆抗体曲妥珠单抗,在一定程度上可以提高肿瘤细胞对抗肿瘤药的敏感性,从而提高有效率。而且进入了乳腺癌的早期辅助治疗使有Her2过度表达的高危病人复发率明显下降。大肠癌、淋巴瘤、肾癌和肺癌的靶向治疗都取得良好结果。
2、考虑细胞增殖动力学
多年来对于肿瘤细胞增殖动力学的知识,结合对各种药物作用机制的认识,为制定安全有效的化疗方案提供了理论基础。细胞群中一般只有部分处于增殖周期。增殖周期中又可分为合成前期(G1)、DNA合成期(S)、合成后期(G2)和有丝分裂期(M)。直接作用于DNA的药物,如烷化剂、抗肿瘤抗生素及金属药等对整个周期中的细胞均有杀伤作用。人们把这类药物称为周期非特异性药物(CCNSC),而把只对某一时期的药物称之为周期特异性药(CCSC),如抗代谢药主要作用于S期,植物药主要作用于M期等。另一部分细胞处于静止期(G0),对各类药物均不敏感,是目前肿瘤化疗的难题之一。
联合化疗中一般都包括两类以上作用机制不同的药物,而且常常应用CCNSC与CCSC药物配合。选药时也要尽可能使各药的毒性不相重复,以提高正常组织的耐受性。药物数量目前一般多主张3-4个药最好,太多了并不一定能提高疗效。
3、肿瘤负荷与肿瘤细胞的异质性
化疗药物对于治疗细胞的杀伤属于一级动力学,即在一定时间内一定浓度的药物能杀伤应为一定比例的细胞。能否达到根治取决于肿瘤对药物的敏感程度、药物的剂量强度、给药的周期和开始时肿瘤的负荷。所以,化疗的疗效在很大程度上取决于肿瘤的负荷。这一概念已经部分应用于辅助化疗,人们试图用手术或放疗将肿瘤负荷或所有肉眼可见的肿瘤祛除或破坏,通过化疗消灭残存的微量肿瘤细胞。
影响所有临床肿瘤内科治疗效果的一个重要因素是临床肿瘤遗传的异质性。虽然大部肿瘤可能是从单一肿瘤克隆发展而来的,但是所有恶性肿瘤在遗传上是不稳定的,并从而导致生物化学的明显异质性。由于遗传的异质性使得蛋白质的表达差异很大,首次化疗敏感的细胞以后会产生变异。这样,对于每个病人的疗效很难预见;一些病人原来敏感但治疗后出现耐药克隆导致无效。联合化疗通过应用不同作用机制的抗肿瘤药至少可以克服一些由于遗传决定的不敏感细胞。在内科治疗前祛除巨块不但能减少总的肿瘤负荷,也会降低耐药细胞的比例。
4、克服耐药
在细胞增殖过程中有一定机率突变,导致抗药细胞的产生。倍增的次数越多,产生抗药细胞的机率越多。研究表明有些肿瘤细胞在化疗开始时即有抗药性,称为天然抗药性; 另一些则是开始时对化疗敏感, 以后逐渐产生抗药性, 即我们这里所说的获得性抗药性。一般认为抗药的发生有以下机制:(1)药物运转或摄取机制发生改变;(2)药物分解酶活性或数量增高;(3)靶酶质或量改变;(4)修复机制变异;(5)药物活化异常;(6)受体减少或被封闭;(7)代谢途径变异细胞保护性基因产物的过度表达或变异影响肿瘤细胞对于抗肿瘤药的敏感性;(8)改变肿瘤氧化作用或血液供应可以影响药物对肿瘤的直接作用或药物达到肿瘤细胞;(9)能够明显影响药物达到肿瘤细胞的宿主正常组织方面的因素,如肾脏和肝脏药物代谢的改变或造血组织对抗肿瘤药物的耐受性等。
一种近十余年才被阐明的抗药性是:一旦肿瘤细胞对某一药物抗药时, 对其它一些结构不同,作用机制也不同的药物也具有抗药性, 即多药耐药(MDR)现象。目前已知和MDR有关的药物是抗肿瘤抗生素如阿霉素、柔红霉素、博来霉素、丝裂霉素等; 植物药如长春花碱、鬼臼碱、紫杉类等; 其他如顺铂和美法兰等。研究发现这和多药耐药基因(mdr-1, mdrp)及由它们调控的P-糖蛋白有关。p-gp实际上是一种跨膜蛋白,能够通过ATP将药物从细胞内泵出。
实验研究已发现很多可以改善耐药的药物,比较重要的有:(1)抑制p-gp泵出作用的药物如异搏定、利血平、酚噻嗪和环孢素-A等;(2)肿瘤坏死因子、免疫毒素、反义寡核苷酸和抗p-gp抗体等。但临床上取得成功的还不多。
开发新作用机制的药物在一定程度上可以克服耐药,这包括近年开发的一大批化疗药物和生物靶向药物等。采用新的非交叉耐药化疗方案对复发耐药肿瘤也有相当疗效,也是目前较为现实的方法。其它关于耐药理论的应用,如将MDR-1转染到骨髓细胞,也可在一定程度上保护骨髓造血功能。
5、根治的概念
??肿瘤化疗正在从姑息性治疗向根治过渡。虽然目前除非洲儿童淋巴瘤、儿童急性淋巴细胞白血病、睾丸肿瘤、绒癌和淋巴瘤以外,单用化疗能够根治的肿瘤不多,但根治的概念十分重要。在制定化疗计划和方案时,应区别治疗的目的是根治还是姑息。不言而喻,如果以姑息为目的是制定治疗具体方案时不应给病人带来很大风险和痛苦,必须衡量治疗可能导致的得失。但在根治治疗即应最大限度地消灭肿瘤细胞,并采用必要的巩固和强化治疗,以期达到治愈。
近年来诱导缓解→扶正治疗→巩固治疗→扶正治疗的治疗模式或程序已广泛用于实体瘤的治疗。是最大限度杀灭肿瘤细胞降低肿瘤负荷以后,有一个修整扶正的阶段使病人的免疫功能和骨髓功能得到恢复有利于病情的巩固,以后采取巩固治疗使肿瘤细胞数目降到106以下,可为机体正常或强化了的免疫细胞消灭,从而达到治愈。
6、剂量强度
从一级动力学角度来考虑,或在临床上很多抗肿瘤药物都有剂量-疗效关系,如果剂量提高则疗效很可能也会有提高。相当多的临床前数据和临床经验支持一种假说:在肿瘤化疗中给予最大耐受剂量甚至超致死量的药物可以达到最大疗效。剂量强度(dose intensity, DI)的概念,是指每周药物按体表面积每平方米的剂量(mg/m2/wk),而不计较给药途径。相对剂量强度(RDI)是和标准剂量之比。
剂量强度的基础是剂量-反应曲线为线性关系,这样剂量愈高疗效也愈大。在临床上这种线性关系只见于淋巴瘤、睾丸肿瘤、乳腺癌和小细胞肺癌等。这也是临床上应用高剂量化疗的基础。目前骨髓和造血干细胞移植、预防行性造血因子的应用及获得成功也充分说明DI在提高肿瘤化疗疗效上的重要意义。通过造血干细胞的支持,高剂量化疗使上述肿瘤的预后正在进一步改观。最明显的例子是应用高剂量化疗治疗急性白血病和淋巴瘤取得成功,并且可以通过异基因或自体骨髓移植以防止或减少由于延长骨髓抑制导致的并发症。由于开展高剂量化疗,有可能使对化疗抗拒的血液系统肿瘤和甚至某些上皮肿瘤缩小和长期无病生存。
7、给药途径
影响药物局部有效浓度条件很多。其中重要的因素是肿瘤的体积。大块肿瘤常常有些区域血供不佳,因之通过血液达到这些部位的药物浓度也低。这一问题可以通过将药物直接注射到肿瘤所在部位解决。例如在肝脏解毒的药物可一通过肝动脉注射到肝和肝肿瘤,而达到身体其余部位的药物很少。在氟尿嘧啶衍生物中氟尿嘧啶和氟尿嘧啶脱氧核苷属于原形药物,从药理学角度适于肝动脉滴注。同样,有的药物适于直接腹腔注射(顺铂)或直接膀胱注射(丝裂霉素),在肿瘤所在的局部药物浓度达到相当高的水平,而全身药物浓度很低。虽然目前对于以上区域性给药能否达到根治有待进一步研究,从药理角度来看优点是肯定的。
对于给药途径的另一个需考虑的问题是肿瘤的掩蔽所。从药理学角度身体的有些部位肿瘤可以生长,但抗肿瘤药不能到达。在临床上,血脑屏障和血睾丸屏障就是范例。血组织屏障是由血管内皮细胞和基底细胞膜组成的。血脑屏障使大分子的和生物制剂不能穿透脑实质和脑膜。但是肿瘤能够侵犯血脑屏障进入脑实质或脑脊髓膜腔。这可以解释有的肿瘤例如急性淋巴细胞白血病或小细胞肺癌化疗后全身肿瘤达到完全缓解,而中枢神经系统复发。
8、注意给药方法、间隔合理用药
CCNSC对肿瘤细胞的作用较强而快,能迅速杀灭癌细胞;CCSC一般作用较弱而慢,需要一定时间才能发挥作用。CCNSC的剂量反应曲线接近直线,在体内能够耐受的毒性限度内,其杀伤能力随剂量而提高;在浓度(C)和时间(T)的关系中C是主要因素。而CCSC则不然,其剂量反应曲线是一条渐近线,即在小剂量是类似于直线,达到一定剂量后不再升高出现平坡。相对来说,在影响疗效的因素中T是主要的。这样,一般来说为了发挥化疗药物的最大效用,CCNSC应静脉或动脉内一次推注;而CCSC则应缓慢滴注、肌注或口服为宜。
很多多药物在开始时并不是按这些原则给药的。但通过实践根据病人的耐受和疗效逐渐调整到目前的常规方法。例如早期环磷酰胺是每周3次每次200mg,后来实验和临床研究改为每周一次;有效的CCSC药物如长春花碱(VLB)和氟尿嘧啶长时间滴注疗效明显提高。紫杉类最初均推荐每3周用药一次,通过实践无论欧美和我国均在观察每周给药一次的疗效和耐受性可能优于3周一次的方案;而喜树碱衍生物则有原来的每周给药一次或二次,改为连续给药几日每3周一次。联合化疗用药的次序和间隔是当前研究的重要课题之一。例如甲氨蝶呤滴注6小时后再进行氟尿嘧啶滴注疗效最好而且毒性减低;卡铂和健择以卡铂给药4小时后在给予健择的疗效最好;顺铂与健择联合用药,如将健择在第1、8天给药,将顺铂放在第8天,不良反应会有减轻等。
 |
| 肿瘤治疗 |
9、给药个体化
肿瘤内科治疗的成功很明显与一些宿主因素相关,其中包括营养状态、活动能力、重要器官的综合功能等。这些因素对于化疗能够成功的影响是显而易见的。例如,具体病人对一个药物毒性的耐受能力和承受这一药物毒性的器官功能相关。如果对于药物代谢或排泄必要的器官功能受的损伤,毒性会相应增大。叶酸拮抗剂甲氨蝶呤通过肾排泄。甲氨蝶呤的毒性在肾功能不正常的病人比肾功能正常的病人有相当程度的增高。这是直接由于甲氨胺蝶呤清除降低,机体暴露于甲氨蝶呤的时间延长。对于需要治疗但脏器功能不正常的病人,提高对于具体抗肿瘤药的药物动力学方面和对于代谢和排泄途径的知识,有助于粗略调整剂量。
很多报道说明病人的活动功能状况对预后的影响很大。活动功能状态反应了整体器官功能的综合情况。在活动功能状态不好的病人各种治疗的毒性都较明显,即使是治疗剂量和支持治疗都很适当,他们的生存时间也较短。
多年来由于病人的机体状况不同、肿瘤的不均一性、个别对待是临床治疗的基本原则之一。化疗的剂量主要靠医生的经验,参考病人的肿瘤负荷、骨髓和肝肾功能决定。最近已有人根据药物代谢曲线的曲线下面积(AUC)具体计算病人的合适剂量,从而达到MTD取得最大疗效并避免不可耐受的毒性。
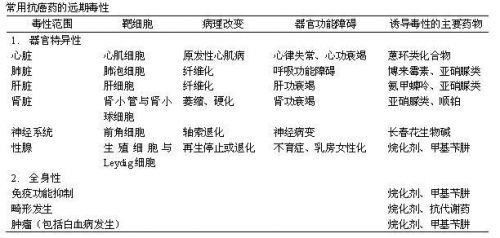
(二) 抗肿瘤药物的近期和远期不良反应
所有细胞毒类抗肿瘤药物都应当视为有毒药物,必须谨慎、合理应用,因为药物本身可能引起严重不良反应。医生必须对这些药物有较深的了解,包括药代动力学特点,药物之间的相互作用,是否有器官特异性毒性,预防和谨慎观察过敏反应。合理用药是相对的,要不断学习不断提高业务水平,才能胜任临床工作。并根据循证医学、规范化和个体化的原则减少失误,使病人获益。
1、抗肿瘤药注意事项:
(1)、治疗前所有病人的必须有明确的诊断,一般应当有病理或细胞学诊断。多数抗肿瘤药物均有一定毒性,所以不能作“诊断性治疗”或安慰剂,以免给病人带来不必要的损失;
(2)、病人需要一般状况较好,血象和肝肾功能正常才能耐受抗肿瘤治疗。
2、抗肿瘤药物的不良反应:
(1)急性和亚急性不良反应 指在用药后当时和疗程内出现的过敏、恶心呕吐、腹泻;血液学、肝肾功能、手指麻木、皮疹、手足综合征和脱发等;
(2)长期不良反应 指在停药后甚至停药后多年出现的不良反应,包括神经毒性、造血功能障碍、间质性肺炎、心脏毒性、内分泌失调、畸胎等。并且根据严重的情况分为1、2、3、4度。1度是指轻微反应,2度是中度反应,3度为严重反应,4度是可以致命的严重不良反应。WHO和美国NCI对各系统的不良反应分度均有明确的规定。不言而喻,在治疗实施过程中1、2度是允许的,3度是应当避免的应当调整剂量,出现4度不良反应需要立即停药并进行处理、急救。
(三)化疗的辅助治疗
化疗的不良反应可以长期或暂时影响患者的生活质量,可能限制治疗的剂量及疗程,严重者有时还会危及生命。化疗的诸多不良反应使得研究者开发出多种特异性的药物来减轻或消除某些特定的不良反应。理想的化疗辅助用药应该可以预防各种不良反应,同时对药物的抗肿瘤作用不产生任何影响,而且使用方便,费用低廉。但是,大多数化疗辅助性药物的作用范围都相对较小,仅能作用于不良反应某一特定的方面。尽管如此,化疗辅助药物的发展对化疗疗效的提高及不良反应的减少作出了巨大的贡献。
1、重组人粒细胞集落刺激因子
目前临床应用的重组人粒细胞集落刺激因子(rhG-CSF)已被70多个国家批准用于治疗肿瘤化放疗导致的中性粒细胞减少症、骨髓移植后的造血功能抑制、严重的慢性粒细胞减少症、急性白血病、再生障碍性贫血、骨髓增生异常综合症和外周血干细胞动员。由于rhG-CSF的应用,有效地预防和治疗了化疗导致的中性粒细胞减少症,减轻了化疗后粒细胞减少的严重程度,缩短了化疗后粒细胞减少的持续时间,使粒细胞减少得以快速恢复,使化疗可以按计划如期进行,降低了由于粒细胞减少引起的感染等并发症的发生机率,从而提高了化疗的安全性,使患者可以接受足量化疗。
2、 重组人白细胞介素-11
白细胞介素-11(IL-11)是一种多效性的造血生长因子,可刺激多种造血祖细胞的分化增殖。IL-11单独应用可诱导巨核细胞的分化并增加体积,促进早期祖细胞的分化。用于预防非血液系统恶性肿瘤化疗所致的重度血小板减少症,降低化疗导致的重度血小板减少的发生率,减少血小板成份输血的次数,主要毒副反应是外周水肿、呼吸困难和结膜充血。
3、重组人促红细胞生成素
贫血是肿瘤患者最常见的并发症,化疗引起的贫血是在不知不觉中发生的迟发性并发症。直到90年代,伴有症状的肿瘤性贫血,红细胞输注一直是唯一有确切疗效的治疗方法,但会增加各种感染的风险。重组人促红细胞生成素(EPO)最初用于治疗慢性肾衰引起的贫血,此后,人们探讨EPO代替红细胞输注治疗肿瘤患者贫血的可能性。ASCO和美国血液学会(ASH)提出了基于循证医学的EPO临床应用指导原则,对 Hgb≤10g/dl的化疗相关贫血患者,推荐将EPO作为使用的选择,红细胞输注仍然是可供选择的治疗方法; Hgb为10g/dl~12g/dl的患者,应根据临床情况决定是立即应用EPO或是等到Hgb≤10g/dl时再开始应用。
4、5-羟色胺3(5-HT3)受体拮抗剂
化疗引起的恶心、呕吐是癌症患者最为恐惧的不良反应,对恶心、呕吐控制不足会产生一系列相关的并发症,如脱水、电解质紊乱等。恶心、呕吐还可显著影响患者的生活质量,严重的恶心、呕吐会导致患者拒绝接受进一步化疗。
已有多种药物用于化疗引起的恶心、呕吐的控制,如吩噻嗪类、多巴胺拮抗剂、抗组胺药等。自1987年开发出第一代高选择性5-HT3受体拮抗剂恩丹西酮以来,一批5-HT3拮抗剂的衍生物相继问世,如格拉司琼、托烷司琼、雷莫司琼、阿扎司琼等。多数研究证明,5-HT3受体拮抗剂在防治化疗所致急性呕吐方面有效率高、耐受性好,因此目前被大多数医生作为治疗急性呕吐的常用药物。
5、 氨磷汀
氨磷汀(Amifostine ,Ethyol)是一种有机硫代磷酸盐,50年代由美国军人筛选出来,用作核辐射的保护剂。它产生的巯基可清除对细胞产生损伤的氧自由基。它是广谱的细胞保护剂。临床前研究显示,氨磷汀几乎可以选择性地保护所有正常组织(除中枢神经系统以外),而对肿瘤组织无保护作用。
临床用于减轻化疗导致的肾毒性和血液学毒性。
6、双膦酸盐
恶性肿瘤常伴有骨质丢失,如多发性骨髓瘤、晚期肿瘤的骨转移,常导致病人出现顽固性疼痛、功能障碍、病理性骨折、脊髓压迫及高钙血症等一系列问题,严重影响患者生活质量。对骨转移患者的治疗,目前临床上除了常规的抗肿瘤治疗外,双膦酸盐类药物也是常用的药物之一。
双磷酸盐与骨有高度亲和力,它能抑制破骨细胞对骨小梁的溶解和破坏,因此,能阻止肿瘤引起的溶骨性病变、减少骨吸收、减轻疼痛及由骨转移所致的高钙血症及其它相关事件。目前还认为肿瘤细胞导致骨质破坏,而破坏的骨质释放的细胞因子或生长因子又能刺激肿瘤细胞的活性和生长。双膦酸盐类药物能阻断这种作用,减慢骨转移的发生和发展,并可导致某些肿瘤细胞的死亡。双磷酸盐对骨质疏松症也有一定疗效。
第一代双膦酸盐类药物羟乙膦酸钠、氯屈膦酸钠,第二代双膦酸盐类药物帕米膦酸钠,大量的临床研究表明这类药物在改善乳腺癌骨转移和多发性骨髓瘤患者的疼痛、控制病情、预防骨转移的并发症和提高生存质量方面起了较好的作用。第三代双膦酸盐类药物伊班磷酸盐、唑来磷酸,能显著降低恶性肿瘤骨转移的高钙血症,降低尿钙的吸收,并可增加骨矿密度,减少骨代谢紊乱。目前还可用于治疗绝经后妇女骨质疏松。
双磷酸盐的应用目前还不能完全代替癌痛的标准治疗-止痛药物和局部放疗。由于在对照研究中发现双磷酸盐对疼痛有控制作用,对全身治疗或放疗后仍有疼痛的患者应用双磷酸盐类药物。
7、美斯那(Mesna)
烷化剂异环磷酰胺(IFO)和环磷酰胺(CTX)在对多种恶性肿瘤有效,但是IFO和大剂量的CTX会导致出血性膀胱炎的发生,成为这二种药物的剂量限制性毒性。IFO和CTX出血性膀胱炎的发生率报道不一,随着药物剂量的增加发生率也相应增高。Mesna是特异性的尿路保护剂,它的应用显著减少了出血性膀胱炎的发生率。
8、亚叶酸钙(CF)
CF(N5-甲酰亚叶酸)是叶酸的活性形式,也是人体一种必需的营养因子。叶酸与嘌呤、嘧啶的合成及氨基酸的代谢密切相关。其临床应用包括以下方面。
CF与5-氟尿嘧啶(5-FU)合用提高5-FU的疗效。临床上,5-FU与CF的合用常见于各种消化道的恶性肿瘤,如胃癌、大肠癌等。有作者研究发现,在晚期大肠癌患者中,单用5-FU与5-FU、CF合用的有效率存在显著性差异(11%和23%,P<0.001)。
大剂量氨甲蝶呤(MTX)的解救治疗。氨甲蝶呤与叶酸的结构相似,它可在细胞内竞争性地与二氢叶酸还原酶相结合,阻断二氢叶酸转变为四氢叶酸,从而抑制DNA的合成。CF进入体内后,通过四氢叶酸还原酶转变为四氢叶酸,从而有效拮抗MTX的作用。因此外源性给予CF可以越过MTX所作用的部位,使正常的生化反应能够继续进行起到解救作用。
进入21世纪循证医学、诊疗规范化和个体化已经成为临学术界公认的趋向。可靠的临床试验和从中得出的数据将使我们愈来愈明白在一定情况下何种治疗更好?从而使疗效进一步提高。 这就把科学严紧的临床试验提到更高的地位,在肿瘤临床中就更为重要。临床试验规范(Good Clinical Practice, GCP)的核心只有两条:一是安全性,二是科学性。为了病人的利益,人们必须不断提高临床试验的水平。当前,临床肿瘤学正处于一个重大变革时期,循证医学、诊疗规范化和个体化已经成为大家努力的方向。由于临床研究发展很快,多数新药均需要和标准治疗方法对比。目前国际上正在树立一种新的概念:“参加临床试验能得到最新、最好的治疗”。
一、进入临床试验的新药应具备的条件
进入临床试验新药由于对象为人,一方面需要注意科学性,另一方面必须保证对病人没有损害。这也是赫尔辛基宣言的基本要术。世界各国一般对药物及病例的选择要求以下五方面条件:
1、对药物的化学结构或成分、性质、质量控制、在体外和动物体内的抗肿瘤作用、毒性、体内代谢等必须有一定了解。临床肿瘤学家只能从药理学家手中接受新药经药政部门批准后开展临床研究。不经一定临床前研究和审评程序就开展临床研究是违法的和不负责任的。
2、所选病例应有可靠的诊断,一般要求有病理细胞学诊断,确定原发及转移的部位。
3、排除以往治疗的影响。在试用新药时我们一般要求两种治疗之间应有一定间隔,为了避免以往放射或化学治疗的后期影响,对于一般肿瘤最好间隔1-2月以上。
4、在临床试验的第Ⅰ、Ⅱ期应当使各方面条件尽量一致,减少一些未知因素的影响,最好采用单一药物治疗。在试验的Ⅲ、Ⅳ期与其他药物进行对比及确定在综合治疗中的地位时,必须有足够的例数及严格的对照,不然所得结论就不易可靠。除非特殊情况外Ⅱ期临床研究应有单药或至少部分病例单药治疗的观察。
5、负责试用的临床医师必须具有一定肿瘤学知识,应当熟知其他治疗手段(手术、放射线及常用的化学药物)可能取得的效果。对一般肿瘤只有在常规治疗手段不能解决病人问题,或治疗后复发及无效的病例才试行药物治疗。在开始试用前应确定能作为观察指标的客观表现。。
二、临床试验的伦理问题和GCP指导原则
如何使广大群众理解临床试验的意义和重要性,向病人和家属解释临床试验的具体内容并使病人愿意合作,是一个现实的问题。国际上正在树立一个新概念:“临床试验可以给病人提高最新最好的治疗”。我们正是为了解决病人的问题才开展临床研究,和病人的追求和利益应当是一致的。
伦理委员会是进行临床研究的权威机构。各种临床研究在启动前必须经过他们批准,在进行过程中和结束时也均需要报告。从而保证赫尔辛基宣言的具体实施。
GCP是用以设计、实施和报告临床试验的一种规范,以便向公众保证资料的完整可靠、患者的权益和隐私能得到保护。我国卫生部和国家药品监督管理局对新药的临床试用方法十分重视。1998年颁布了《药品临床试验管理规范》(试行),并在全国各地举办GCP培训班。 1999年国家药品监督管理局颁布规范做为正式法规,2003年又进一步做了修订。
三、临床试验的分期和要点
目前国际上已经有了统一、公认的方法。一般可以将新药试用的步骤分为四期。
四、临床试验存在的问题
尽管新抗肿瘤药物的临床研究已经积累了相当经验,存在的问题仍然不少。最大问题是疗效和不良反应的预报体系尚不够完备。此外,由于肿瘤本身的不均一性,疗效和不良反应在不同人群的差异也较大。所以,基础研究十分重要。
近年来除了细胞毒类以外肿瘤治疗的靶点增多,也为临床试验在方法学方面带来困难。例如生物治疗的临床试验方法显然不能和细胞毒类一样,前者的合适剂量是提高免疫或基因功能的剂量而不是我们这里所述的MTD; 前者的靶点和化疗也不相同观察指标也不能一样; 前者更重视生存质量(QOL)和时间而不主要是肿块缩小,并且更重视生活质量的改善和远期结果。制定国际统一的试验方法是无疑是当前一个重要的研究课题。
肿瘤的生物治疗主要是通过调动宿主的天然防卫机制或给予机体某些物质来调节宿主与肿瘤的反应以取得抗肿瘤的效应。肿瘤的生物治疗函盖的内容非常广泛,而肿瘤的靶向治疗(targeted therapy)是根据对肿瘤细胞受体和增殖调控的分子水平发病机制的认识,以细胞受体、关键基因和调控分子为靶点的治疗。其特点是抗肿瘤作用是非细胞毒性的,主要对肿瘤细胞起调节和稳定作用,具有一定的选择性和特异性。靶向治疗是肿瘤生物治疗的一个重要组成部分,是近十年来肿瘤研究中发展最为迅速的领域之一。随着现代生物技术的发展,生物和靶向治疗日趋重要,已经逐渐成为治疗肿瘤的第四手段了。它日益增加的临床应用是基于两方面的发展;其一是对抗肿瘤防卫机制的基础理论的深入理解,其二是生物技术的迅速发展使得临床上大规模运用生物反应调节剂成为可能。生物和靶向治疗虽然仍是处于发展的初期,但已有很多典型的病例及其反映出来的理论探索的成功性足以激发人们将这一疗法继续向前推进。21世纪的肿瘤治疗,抗癌药物的发展将从细胞毒性药物的攻击转向非细胞毒性药物的调节。其中生物和靶向治疗将起到极其重要的作用。
一、生物反应调节剂
生物反应调节剂(biologic response modifier,BRM)的概念涉及范围较广。既包括一大类天然产生的生物物质又包括能改变体内宿主和肿瘤平衡状态的方法和手段。虽然作用机制多种多样,但不外乎两大方面。通过干扰细胞生长、转化或转移的直接抗瘤作用或通过激活免疫系统的效应细胞及其所分泌的因子来达到对肿瘤进行杀伤或抑制的目的。
(一)定义
Mitchell曾对BRM有过很具体的定义。一种物质只要具备以下条件之一的就可称为BRM:直接增强宿主抗肿瘤的反应。经免疫刺激来增加效应细胞的数量或活性,或增加可溶性中介物,如淋巴因子或单核因子等的生产;通过减少抑制性机制而间接增强了宿主对肿瘤的免疫反应;增强宿主对细胞毒物质造成损伤的耐受能力,如通过增加骨髓的白细胞前体来提高化疗病人的耐受力;改变肿瘤细胞细胞膜的特点以增强它们的免疫原性,改变转移方式或使瘤细胞对免疫杀伤机制或细胞毒药物更敏感;预防或逆转细胞转化,或促进不成熟肿瘤细胞的成熟。Mihich的定义就更加广泛了:一种物质或方法,能通过调整宿主对肿瘤的反应使二者之间的相互作用朝向有利于治疗肿瘤的方向发展,均可叫BRM。根据这个定义,除某些药物、细胞因子外,凡是借助于生物学技术的一些新的方法和手段如某些基因治疗等均可列入这个范畴。
(二)生物反应调节剂的种类
根据BRM的定义,从目前的研究资料来看,BRM有下列种类:
1. 天然或基因重组细胞因子:包括白细胞介素(interleukin)、干扰素(IFN)、肿瘤坏死因子(TNF)、集落刺激因子(CSF)等。
2. 抗肿瘤的各类体细胞和辅助性的造血干细胞:如LAK细胞、TIL细胞、TAK细胞、CIK细胞;利用异基因移植物抗肿瘤效应(GVT)的供体淋巴细胞输注;骨髓干细胞、外周血和脐带血干细胞等。
3. 抗体:包括各类抗肿瘤单克隆抗体、抗细胞表面标记抗体等。
4. 基因治疗:如重组人p53腺病毒。
5. 肿瘤疫苗:如采用基因修饰的肿瘤细胞或肿瘤抗原多肽作为疫苗,负载肿瘤抗原的树突状细胞(DC)等。
6. 抗血管生成类:包括一些小分子物质如恩度(Endostatin)、反应停,抗VEGF受体的单抗如Avastin。
7. 细胞分化诱导剂:如砷制剂、维甲酸。
8. 酶制剂及酶抑制剂:如酪氨酸激酶的小分子抑制剂伊马替尼(Gleevec)、吉非替尼(Iressa)、艾罗替尼(Tarceva);蛋白酶体抑制剂万柯(Velcade)。
9. 某些微生物及其有效成份的制剂:如卡介苗(BCG)、短小棒状杆菌(CP)、链球菌(0K432)、济南假单胞菌等。
10. 植物药包括中药的有效成份:如香菇多糖、云芝多糖、黄芪多糖、刺五加多糖、扶正女贞素LL-E、枸杞多糖、淫羊藿多糖、商陆多糖、人参总皂苷、冬虫夏草等。
11. 有机酸及小分子合成剂:如左旋咪唑(1evamisole)。
12. 其他。
各类BRM在抗肿瘤作用中虽然机制有所不同;但不是孤立行动的。它们相互间有一定的关系和影响,形成了BRM的作用网络。它们与免疫系统、内分泌系统、神经系统等相互影响与协调,共同维持生命机制的稳定与平衡。这就是生命机制的稳态论(homeostasis)。美国学者Oldham在1984年提出了生物调节(BRM)理论后,这一领域发展极快,尤其是近年来单抗、小分子酪氨酸激酶抑制剂等靶向治疗药物,已经突破了发展的瓶颈,开始广泛应用于临床。
二、各类生物治疗和靶向治疗
生物治疗的领域涉及面极广,几乎生物反应调节剂的所有方面都有不同程度的进展。本文仅就细胞因子;过继性细胞免疫治疗;肿瘤疫苗;基因治疗;单克隆抗体;酶抑制剂;抗血管生成药物等方面的进展和问题作一代表性的介绍。
(一)细胞因子
自从基因工程技术在生物医学领域中大规模发展使用后,细胞因子是应用最广泛,疗效最明确的一类BRM。现以干扰素(IFN)、白介素(IL)、集落刺激因子(CSF)、促红细胞生成素(EPO)、促血小板生成因子(TPO)等为例并简要说明它们的临床使用情况。
1.干扰素(IFN):IFN是一种糖蛋白,首先是由Isaacs和Lindenmann在1957年作为一种病毒感染的细胞产物来描述的,它可以防止病毒的进一步感染。IFN的主要作用有直接抗病毒作用;增强主要组织相容性抗原(MHC)和肿瘤相关抗原(TAA)的表达;增强自然杀伤细胞(NK)的细胞毒作用;增强抗体依赖性细胞的细胞毒(ADCC)作用;直接的抗细胞增殖作用和抗血管生成作用等。IFN有三种,即IFN-a、IFN-b和IFN-g。IFN-a和IFN-b具有相同的受体即I型受体,IFN-g联接在Ⅱ型受体上。
IFN-a是第一个用于临床的重组基因细胞因子,可皮下或肌肉给药,血浆半衰期4-6小时,生物活性持续2-3天。于1981年开始临床试用,1986年被FDA正式批准。
2.白细胞介素(interleukin,IL):白细胞介素(简称白介素)这一名称是特指由白细胞产生的可以调节其他细胞反应的任何可溶性蛋白质或糖蛋白物质。在强调这些多肽物质在免疫系统所起的协调作用的这一名称时,它与生长因子(growth factor)这一称呼的区别是人为造成和误导的。因为大多数白介素就是生长因子,反之也一样。作为免疫反应的激素,白介素是通过内分泌(endocrine)、自分泌(autocrine)和旁分泌(paracrine)等的相互作用来实现的。这种白介素连锁反应的发生首先是由病原性接触和特异性抗原性反应在局部开始的,由于分泌的白介素有所不同,各类效应细胞表面所分布介素受体种类和数量的不同而引发了各自不同功能的表达。这些细胞包括造血细胞、免疫细胞、内皮细胞和某些非免疫系统的细胞。而白介素的旁分泌作用包括了引发、放大、维持和终结不同阶段的免疫反应等。此外,白介素也通过对血管内皮细胞、成纤维细胞、角化细胞、脂细胞等的作用发挥全身调节作用。目前,以白介素命名的细胞因子已有十余种。其中,以白介素—Ⅱ(IL-2)研究得最为深入,应用最为广泛。其它如IL-3、IL-6等也已进入临床研究,IL-11已批准上市。
IL-2是一种133氨基酸的糖蛋白,分子量15kd,含一链内二硫键。通过T细胞、B细胞、NK细胞、巨噬细胞表面的受体而起作用。由于它能支持T细胞的生长,最初在1976年被定名为T细胞生长因子。IL-2和IFN代表了Thl辅助细胞产生的主要的细胞因子。IL-2是由抗原和IL-12所诱导的,可被IL-4和IL-10反相调节。IL-2在T细胞的生长成熟中起了关键性的作用。它的多种生物学功能主要包括诱导抗原刺激的T细胞增殖,增强MHC限制性抗原特异性T细胞的细胞毒作用;诱导大颗粒淋巴细胞、NK细胞的MHC非限制性LAK活性;对其他细胞因子的诱导作用。
1985年12月美国国家肿瘤研究所(NCl)的Stephen Rosenberg在《新英格兰医学杂志》上首次报道了25名晚期黑色素瘤和肾癌病人经大剂量IL-2加LAK细胞治疗后,有效率达44%。这一成绩轰动了世界并开创了IL-2及其所诱导细胞治疗肿瘤的临床应用。经过十几年的临床实践和全世界各大研究所和医院的努力,对于IL-2治疗肿瘤的评价也日趋客观和冷静。
FDA批准IL-2用于转移性肾癌的基础资料是从7个机构参加的多中心性研究的255名病人中获得的。所用方案由NCI外科部提供,总有效率14%,包括CR 4%。有效部位包括肝、肾上腺、肾床、肾原发部位、肺和淋巴结等转移处。总有效率虽然不高,但中位有效时间长达20个月,大部分CR者长期存活。这说明了这一疗法可以给一部分晚期病人带来一定好处。IL-2对黑色素瘤的治疗也处于与肾癌相似的状态。在美国的3个临床Ⅱ期研究表明,用NCI外科部高剂量方案在134名病人中仅获总有效率20%的结果。其中,5名占4%,22名PR占16%(5)。由于有效率不高,有效持续时间较短,联合其他BRM和化疗药物的化学免疫学治疗(chemo-immunotherapy)或生物化学治疗(bio-chemotherapy)正在积极开展中。在黑色素瘤所进行的大量临床研究结果表明,有效率稳定在45%-60%。是该病种目前有效率最高的治疗手段。
3.造血生长因子(hematopoietic growth factor):造血生长因子是一类细胞因子的总称。它们都可以影响造血细胞,在主细胞的生长和分化上起重要的调节作用,在成熟造血细胞的功能激活上也起重要作用。迄今已有25种以上的细胞因子被证明对造血活性有影响。目前美国FDA批准正式临床使用的有5种,即粒细胞生长因子(G-CSF)、粒细胞—巨噬细胞生长因子(GM-CSF)、促红细胞生成素(EPO)、血小板生成因子(TPO)和白细胞介素11(IL-11)。
(二)过继性细胞免疫治疗
1、LAK细胞
1980年代初期以来,对淋巴因子激活杀伤细胞(LAK)的特征进行了广泛的研究。这是一群不同于NK或CTL的溶细胞性群体。它们细胞表面标记特征为非MHC限制性杀伤细胞。可以是CD3+或CD3的非粘附性的并带有NK,样标记如CD16+和CD56+的细胞群体。新鲜肿瘤靶细胞上被LAK细胞识别的决定簇性质尚不清楚。这种决定簇广泛表达于新鲜和培养中的肿瘤细胞上和培养的正常细胞上。但新鲜正常细胞上并不具有。LAK细胞是外周血淋巴细胞在病人开始IL-2治疗几天后反跳性增殖时收集的。在体外与IL-2一起培养数天后发展为具高度非特异性细胞毒性细胞后再返输给病人。
迄今,没有令人信服的证据说明加用LAK细胞后,疗效比单独使用IL-2要好。再加上治疗的费用和繁琐性,这一疗法基本已被放弃。只有在移植后淋巴细胞增殖性病(post transplantation lymphoproliferative disease,PTLD)中最近重新试用了LAK细胞并取得一定疗效,但要注意不能同时输注IL-2,以免刺激淋巴性肿瘤生长。
2、肿瘤组织浸润的淋巴细胞(Tumor infiltrating lymphocyte,TIL)
TIL是直接从肿瘤组织中分离出来的T淋巴细胞,经在离体培养(ex vivo)中由IL-2诱导而成。具有肿瘤特异性杀伤活性,特别是对黑色素瘤有效。早期的报告与单独使用IL-2对比具较高的有效率(34% vs 17%)。但可重复性和缓解时间的长期资料尚缺。此外,需要新鲜的肿瘤组织和长时间的细胞培养,与相应的费用加在一起考虑,使之能在临床研究阶段以外的实际应用成为问题。
3、体外激活细胞 (in vitro sensitized,IVS)
其特异性是介于LAK和TIL细胞之间的,需要肿瘤细胞作为抗原来刺激。其中TAK(tumor antigen-activated killer)细胞就是典型代表。外周血淋巴细胞分离出来后,经肿瘤可溶性膜抗原、抗CD3单克隆抗体和IL-2一起培养扩增后返输给病人,达到治病的目的。中国医学科学院肿瘤医院生物治疗协作组用该种疗法曾观察了20名晚期肾癌病人,其中CR 1名,PR 4名,有效率为25%。截止到1996年7月平均生存13个月,本疗法所用细胞数量是109级,远远低于Rosenberg等所用LAK细胞的1011级,但疗效在同一水平上。这说明TAK比LAK有更好的特异性,因此攻击性强。但仍有一些问题需要解决,如抗原强度和呈递表达的效率,共刺激信号的提供等,因此疗效不稳定。本来免疫原性较强的黑色素瘤效果反而不好。因此如何使用过激性细胞免疫治疗更好地应用于临床实践还需深入研究。
4、细胞因子诱导的杀伤细胞(Cytokin-Induced Killer Cell, CIK)
CIK细胞是体外用IFN-Y、IL-2、抗CD3单抗激活、表型为CD3+CD56+CD16-的细胞毒细胞,属非MHC限制性效应细胞,其细胞毒作用比LAK细胞更强,对LAK细胞几乎不能识别的自体CML细胞也有杀伤作用。CIK细胞在体外需IL-2等激活,输入体内后则不需要外源性IL-2维持、扩增其活性。Schmidt-wolf IGH等在小鼠人淋巴瘤模型中比较了与LAK的效果,CIK组能引起更明显的肿瘤消退,CIK治疗组小鼠有长期存活,LAK组则无。国内外的临床研究显示CIK细胞治疗NHL、AML、MM、肾癌、结肠癌等有效,其中治疗NHL的CR达到75%(9/12)。
5、供体淋巴细胞输注(Donor Lymphocyte Infusion,DLI)
同种异基因淋巴细胞可以识别宿主细胞表面主要组织相容性抗原MHC、次要组织相容性抗原及肿瘤相关抗原,具有抗瘤作用。异基因造血干细胞中含有CD4+细胞、NK细胞、LAK等效应细胞,均可产生移植物抗肿瘤(GVT)效应。Slavin等1986年为第一例造血干细胞移植后复发的病人施行了供体淋巴细胞输注(DLI)。此后报道了163例异基因干细胞移植后复发患者给予DLI治疗的结果,其中CML105例,72%达 CR,其他(AML、MDS等)58例,44.8% 达CR。单用DLI失败者,用IL-2+DLI治疗仍可达到缓解。
(三)肿瘤疫苗
受疫苗在感染性疾病治疗中的影响,肿瘤疫苗在20世纪初开始使用于临床。近年来,通过对免疫系统的识别机制、肿瘤细胞抗原特性的再认识,针对肿瘤细胞的特性,已建立和发展了多种用于进行肿瘤主动免疫的新策略和新方法。这包括(1)刺激机体的非特异性免疫反应;(2)采用灭活的肿瘤细胞作瘤苗;(3)采用肿瘤抗原或抗原多肽作瘤苗;(4)利用共刺激分子和细胞因子增强机体对肿瘤的免疫应答能力。用肿瘤疫苗进行主动免疫治疗的目的是:克服因肿瘤产物造成的免疫抑制状态;刺激特异性免疫来攻击肿瘤细胞;增强肿瘤相关抗原(TAA)的免疫原性。
纽约Kaplan肿瘤中心观察到神经节苷脂类黑色素瘤疫苗可刺激CD8+T细胞对黑色素瘤相关抗原MAGE-3和MART-1/Melan-A作出相应反应,而且是HLA-A2(Class I HLA)限制性的。15名HLA-A2+黑色素瘤病人术后上述反应阳性者随访12-21个月时仍无复发,而阴性者3-5个月内复发。
最有希望的是树突状细胞(Dendritic Cell,DC) 体外负载肿瘤蛋白多肽的治疗性疫苗,DC是体内最有效的专职抗原呈递细胞,被肿瘤相关蛋白或肽刺激后,激活T细胞,产生抗肿瘤及细胞溶解作用。其缺点是在大多数肿瘤中,没有可被DC呈递的供T细胞识别的抗原决定簇,不同个体的肿瘤抗原性也可不同,因而寻找能被T细胞识别的各种肿瘤的共用肽很困难。DC肿瘤疫苗的产生方法主要包括以下几种:1、利用肿瘤相关抗原或肿瘤表型肽,刺激DC;2、将肿瘤抗原编码基因导入DC;3、或者体外将肿瘤细胞与DC融合,回输给病人,激发抗肿瘤效应。初步研究结果显示,临床应用DC是可行的,Rosenberg和Nestle等在Nature Medicine上分别报导了采用人工合成的抗原多肽或肿瘤细胞裂解物,负载到从患者自身的培养DC上,对黑色素瘤患者的治疗结果。Nestle的治疗结果表明16例免疫病人中的11例具有确定的细胞免疫应答反应的产生,其中5例患者有客观体征的改变等。Rosenberg的临床结果发现,91%的患者具有确定的免疫学指标的改善,在同时接受DC/多肽疫苗和IL-2应用的患者中,42%的病人具有客观体征的改变,而两组临床实验均未发现有自身免疫指征出现。这表明肿瘤抗原多肽或肿瘤细胞的裂解物负载的DC肿瘤疫苗,是一种安全有效的抗肿瘤免疫制剂。
(四)肿瘤基因治疗
随着分子生物学的发展以及科学家多年的努力,现已基本确定了细胞基因的缺失、突变引起的细胞生长失控、恶变是恶性肿瘤发病的主要原因。与肿瘤相关的基因改变有癌基因的激活、抑癌基因的突变失活、细胞周期控制基因发生改变等。肿瘤相关基因,特别是有关癌基因、抑癌基因的研究,使人类对肿瘤的认识进入了一个新的时代。
肿瘤的基因治疗的定义可以概括为:将核苷酸转移到靶细胞中以扰乱或纠正某些病理生理过程或其他物质和手段可以通过纠正靶细胞中的基因或基因产物的异常而达同样目的。1988年美国NCI的Rosenberg等提出了肿瘤基因治疗的设想,并于第二年将TNF-α基因和IL-2基因导入肿瘤浸润性淋巴细胞(TIL)用于晚期黑色素瘤病人的治疗。经7例黑色素瘤病人的治疗研究,肿瘤均有不同程度缩小,其中l例病人存活2年以上,1例病人存活近1年,表明此种方法的安全性、可行性和TIL细胞在机体内生存期均符合要求,取得了肿瘤基因治疗的初步成功。
目前,已鉴定的认为可能有治疗价值的基因数量迅速增加,主要包括:与抑癌基因或癌基因相关的基因、免疫刺激性细胞因子基因、病毒酶类基因、药物抗性基因、组织相容性复合体(MHC)基因等。美国FDA已批准的治疗肿瘤的临床试验项目已有项。其中以p53在头颈部肿瘤和非小细胞肺癌做的工作最多。我国SFDA已于2004年4月批准了国产重组人p53腺病毒局部注射治疗头颈部鳞癌,这是世界上首个获得批准的基因治疗药物,目前这一药物治疗其它肿瘤的临床观察还在继续进行中。然而,该药物是通过局部注射给药,多数肿瘤部位药物不能有效到达,能否真正将治疗性基因成功地运用到人体的特定部位中还取决于一个有效的高度选择性的转运系统和高效的基因表达。
目前,肿瘤基因治疗的临床试验进展缓慢,主要原因是基因传送和细胞移植等技术的临床应用尚未得到圆满解决,最为重要的是基因治疗的安全性存在问题,基因治疗中靶细胞种类的选择,基因表达水平对基因治疗以及患者本身的影响,都是基因治疗安全性方面应考虑的问题。今后肿瘤基因治疗的发展方问应是:①加强对肿瘤基因变化规律的进一步认识,努力的方向集中于突变基因的定点修复或诱导抑癌基因的表达和活化,从根本上逆转突变的癌细胞;②改进基因转导技术,找出一种更简单而有效的载体,并且实施基因定传导入,提高转导率和外源基因的表达率,克服基因随机插入可能造成的某些正常功能基因被抑制;③进一步扩大基因受体细胞种类的筛选,提而受体细胞的扩增;④加强转导基因的选样,如抑癌基因、细胞因子基因、肿瘤抗原基因、化疗敏感基因等。
(五) 单克隆抗体
自从Kohler和Milstein 1975年首次描述了单抗后,研制了大量的抗人TAA的单抗。单抗用于诊断目的是发展较快的,在肿瘤的鉴别诊断和诊断上已确定其地位,产品也趋于多样化。例如放射免疫造影(radio immune imaging) 和放射免疫导向手术(radio immuno-guided surgery,RIGS)。近年来单抗在肿瘤的治疗上也已经进入了迅速发展的阶段。
单抗的治疗作用主要是通过以下几方面:通过补体、ADCC或诱导凋亡的直接细胞毒作用;单抗连接到药物、毒素或放射性核素上;抗基因型(特异性)的单抗来诱导特异性免疫反应;抑制生长因子或它们的受体的单抗;离体进行肿瘤净化或激活免疫淋巴细胞等。目前美国FDA已批准了多个治疗性抗肿瘤单克隆抗体上市。
1、 利妥昔单抗(Rituxan,Mabthera,美罗华)
1997年底,FDA批准了第一个单克隆抗体Rituxan用于抗肿瘤的临床治疗。Rituxan是针对B细胞CD20抗原的高纯度人鼠嵌合型单抗,而90%以上的B细胞淋巴瘤表达CD20。Rituxan对复发性和化疗抗拒性的非霍奇金淋巴瘤有48%的有效率,联合化疗有效率则提高到90%以上,目前已有多个随机对照的临床研究证实Rituxan联合化疗能够延长滤泡性淋巴瘤、套细胞淋巴瘤、弥漫性大B细胞淋巴瘤等的无病生存期或总生存期,目前已成为治疗B细胞淋巴瘤最为重要的药物之一。一些自体造血干细胞移植治疗的Ⅱ期研究中,在干细胞动员采集阶段和移植后应用Rituxan进行体内净化,可以明显减少微小残存肿瘤,延长DFS和OS。在2001年在我国批准上市。
2、曲妥珠单抗(Trastuzumab,Herceptin,赫赛汀)
1998年9月FDA通过了第二个用于肿瘤治疗的单抗Herceptin。Herceptin是重组人源化IgG1单抗,它作用的靶目标是具有Her-2基因过度表达的肿瘤细胞。20%-30%的乳腺癌患者存在着Her-2基因过度表达,临床表现为恶性度高,对治疗药物抗拒,预后不良。Herceptin单药治疗乳腺癌的有效率约20%,但与化疗联合应用则明显增加了化疗的敏感性,提高了有效率和延长了生存期。Herceptin与去甲长春花碱(NVB)、紫杉醇、泰素帝等药物有协同作用。多个晚期乳腺癌一线治疗的大型Ⅲ期临床研究证实Herceptin联合化疗对Her-2阳性(FISH)的患者有效率达56%-79%,中位生存时间12.7-17个月。新的资料(NSABP B31,NCCTGN9831,HERA试验)证明对于早期乳腺癌的术后辅助治疗,应用Herceptin与化疗联合及维持治疗能使复发风险降低约50%,明显延长无病生存时间。2002年赫赛汀在中国上市。
3、 西妥昔单抗(Cetuximab,C-225)
2004年2月美国FDA批准Cetuximab上市用于与化疗联合治疗结肠癌、头颈部癌。Cetuximab是针对EGFR的人源化单抗,与EGFR结合后抑制了酪氨酸激酶的活性及以后的信号传导途径,进而抑制肿瘤生长。BOND研究中入组329例EGFR阳性的Ⅳ期结直肠癌病人,随机分入CTP-11联合Cetuximab组和Cetuximab单药治疗组。结果联合组ORR 22.9%,单药组ORR 10.8%,中位TTP分别是4.1和1.5个月,Cetuximab表现出与化疗药物良好的协同作用。进一步的临床研究表明,对于经5-FU和CPT-11治疗失败的结肠癌病人,CPT-11加用Cetuximab继续治疗又能获得17%的PR和31%的SD,总的临床获益率48%,说明阻断了EGFR有可能重新获得对化疗的敏感性。诱导凋亡,DNA损伤,减少CPT-11从细胞内排除等可能与其克服CPT-11耐药的机制有关。目前正在进行的多个Ⅲ期研究指在阐明Cetuximab与FOLFOX4或FOLFRI联合一线或二线治疗晚期结肠癌的效果。 在头颈部肿瘤中,Cetuximab联合顺铂二线治疗复发转移的病人获PR 23%,SD 27%-61%。
4、 贝伐单抗(Bevacizumab,Avastin)
贝伐单抗是美国FDA批准上市(2004年)的唯一的抑制血管生成的单抗,其靶点是血管内皮生长因子(VEGF)。抗血管生成剂可以阻断肿瘤的血液供应,抑制肿瘤生长和形成转移灶。一个突出的优点是由于对肿瘤本身无直接作用,就不会产生肿瘤耐药。贝伐单抗在大肠癌中的研究最广泛。Hurwitz等报道IFL方案或IFL联合贝伐单抗一线治疗晚期大肠癌的大宗Ⅲ期临床研究,两组的有效率为35%和45%,中位生存期15.6和20.3个月,无进展生存分别6.2和10.6个月。ECOG3200研究也表明FOLFOX4加贝伐单抗可以提高有效率和生存率。目前正在进行结肠癌辅助化疗中加用贝伐单抗的研究。E5499研究中贝伐单抗+紫杉醇+卡铂治疗晚期NSCLC,有效率27%。主要不良反应为高血压、蛋白尿、出血等,研究发现鳞癌更易出血,故贝伐单抗更适用于非鳞癌。贝伐单抗在乳腺癌的治疗中也显示与紫杉醇联合能提高PFS。
(六)小分子化合物靶向药物
正常细胞的生长、分化和生理功能很多是通过接受来自细胞外的各种信号来协调实现的,而各种细胞外因子通过与相应的受体结合,引发细胞内的一系列生物化学反应的过程称为信号传导。多数情况下肿瘤细胞中存在着某些细胞信号传导的过度活跃,或正常信号分子过度表达,理论上可通过阻断过度激活的细胞信号传导途径,或抑制过度表达的信号分子的方法,使肿瘤细胞生长速度减慢,直至接近正常细胞水平。阻断方式除了前述的采用特异性单抗类药物与胞外受体结合使之失活外,还可以在胞内多个环节阻断信号传导,最成功的例子是作用于细胞内酪氨酸激酶的一些小分子抑制剂,如Imatinib、Gefitinib、erlotinib。这些药物的抗肿瘤作用可能通过抑制肿瘤细胞损伤修复、细胞周期阻滞、诱导细胞凋亡、抑制血管生成等而实现。除了酪氨酸激酶抑制剂以外,还有其它作用在血管生成、蛋白酶体等的多种小分子药物正在研究中,少量已获批上市。
1、伊马替尼
慢性粒细胞白血病(CML)和部分成人急性淋巴细胞白血病(ALL)的费城染色体是由9号和22号染色体易位造成的,该易位形成了Bcr-Abl融合基因,所产生Bcr-Abl融合蛋白的Abl部分具有酪氨酸活性,这是细胞恶性转化的关键。伊马替尼能够抑制Abl激酶活性,同时也能抑制c-Kit酪氨酸激酶活性,后者是另一种少见肿瘤——胃肠间质细胞瘤(GISTs)的分子病因。伊马替尼单药治疗CML的血液学完全缓解率可达98%,细胞遗传学缓解率53%,其中CR 10%。治疗晚期c-Kit阳性的GISTs病人,有效率54%,临床获益率88%。取得了前所未有的效果,因而成为第一个被FDA批准的酪氨酸激酶抑制剂。
2、吉非替尼
表皮生长因子受体(EGFR)在很多肿瘤中有不同程度的表达,如肺癌(40%-80%)、头颈鳞癌(90-100%)、胰腺癌(30%-50%)等。EGFR在肿瘤细胞的生长、修复和存活等方面具有重要作用,其过表达常提示预后较差。吉非替尼是一种小分子物质,能够有效的抑制EGFR酪氨酸激酶活性,尤其是对于有EGFR基因突变的病人,表现出更好的疗效。2003年获美国FDA批准,2005年在我国上市。
针对NSCLC的临床研究显示吉非替尼单药作为二、三线治疗的有效率约19%,疾病控制率超过50%。但在另一项研究中,吉非替尼与安慰剂对比,未增加生存期。亚组分析显示东方人、女性、不吸烟、腺癌是吉非替尼治疗获益的因素。一项Ⅱ期研究比较吉非替尼与多西他赛二线治疗晚期NSCLC的效果,有效率分别是15.2%和12.7%,疾病控制率82.6%比 63.5%。疗效相似,吉非替尼耐受性更好。对于其它EGFR过表达的肿瘤,吉非替尼也显示了较好的疗效,如在晚期乳腺癌一线与多西他赛联合治疗的临床获益率73.7%,晚期头颈部鳞癌的一线用药临床获益率45%,二线25%。
3、艾罗替尼
艾罗替尼是另一种EGFR酪氨酸激酶抑制剂。Ⅲ期临床研究比较艾罗替尼与安慰剂二线、三线治疗NSCLC,结果艾罗替尼组的中位生存时间延长,这是首个确认EGFR靶向治疗能延长生存期的随机对照研究。但在艾罗替尼与GEM/DDP或PTX/DDP联合治疗初治晚期NSCLC的Ⅲ期研究中,联合组没有显示生存优势。亚组分析中,与吉非替尼类似,腺癌、女性、不吸烟更可能从艾罗替尼治疗获益,而基因突变与否与疗效无明显相关性。
2005年ASCO年会上报道艾罗替尼联合健择比较健择单药治疗晚期胰腺癌,显示联合组的中位生存期延长有统计学差异。这是首次证明小分子EGFR酪氨酸激酶抑制剂与化疗联合优于单纯化疗。因此2005年11月美国FDA又批准艾罗替尼用于晚期胰腺癌的治疗。
三、生物治疗和靶向治疗在肿瘤综合治疗中的原则、作用和地位
人类与肿瘤斗争的历史中,曾经发现很多肿瘤经遭遇某一契机后会自然消退。经某些细胞免疫治疗,细胞因子如白介素Ⅱ等的治疗后,虽然总有效率不高,但有效者的缓解期很长,远远超过同类病种的化疗、放疗效果。这些都说明了机体是有能力与肿瘤作斗争的,传统的生物治疗与其他治疗手段的作用方式不一样,起到了一个帮助已衰弱了的机体恢复与肿瘤作斗争的能力的作用。有人曾预计在小鼠身上肿瘤细胞数量在106时,宿主是有能力与之相抗衡的。将这一数量换算到人身上时应是3.5x109个癌细胞,相当于直径1.5厘米的球形结节。也就是说,只要用各种手段将肿瘤负荷拉倒109以下而同时恢复机体与之抗衡的能力就有望与肿瘤长期和平共处,达到治愈肿瘤的目的。这就提示了传统肿瘤生物治疗的原则。也就是说在大多数情况下生物治疗宜在小肿瘤负荷的情况下使用。
新的靶向治疗药物的出现使得生物治疗领域发生了根本的变化,某些靶向药物的疗效已经不逊色于传统的化疗,而且毒性相对较低。传统的观念受到挑战,靶向药物可以在综合治疗的早期就得到应用,或者与化疗同时使用,病人可以更早更多的从中获益。生物和靶向治疗已不再是常规治疗手段失败后的补救手段,而应与各种常规手段有机配合各起到自己的作用而完成综合治疗的总体任务。目前,正有多种生物靶向类新药进行临床研究,相信今后还会有大量的生物和靶向药物出现,疗效还会进一步提高。肿瘤的治疗正在进入一个崭新的时期。在欣喜的同时还必须注意到,生物和靶向治疗领域还有更多的问题没有解决,更多的现象需要解释,更多的基础理论需要阐明,各种新药的近、远期不良反应也需要长期密切观察。我们面临的是一个更具挑战性的领域。
→如果您认为本词条还有待完善,请 编辑词条
上一篇临床试验(ClinicalTrial) 下一篇头颈部肿瘤
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
0